As enzimas são essenciais para o funcionamento adequado de todos os organismos vivos da Terra. Eles participam da maioria, senão de todas as mudanças químicas na natureza, isto é, em milhões de reações no mundo vegetal e no mundo animal. Vale a pena descobrir o que são enzimas, como funcionam e qual o seu significado para a medicina moderna.
Índice
- Enzimas: Estrutura
- Regulação da atividade enzimática
- Enzimas: Papel
- Enzimas: Nomenclatura
- Enzimas e medicamentos
- Doenças resultantes de enzimas disfuncionais
- Enzimas: uso diagnóstico
- Enzimas e tratamento
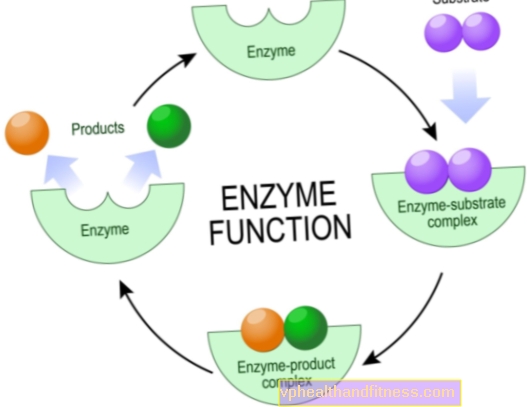
As enzimas são moléculas de proteína que aceleram ou mesmo permitem que várias reações químicas ocorram em organismos vivos, incluindo o corpo humano.
Do ponto de vista químico, são catalisadores, ou seja, partículas que intensificam a reação, mas não se desgastam durante a reação. Esse aumento na eficiência das transformações químicas costuma ser enorme; os catalisadores naturais podem encurtar o tempo de reação de vários anos para vários segundos.
As enzimas são encontradas em todas as áreas do corpo: nas células, no espaço extracelular, nos tecidos, nos órgãos e na sua luz, os catalisadores produzidos por um determinado tecido determinam as suas propriedades específicas e o papel que desempenham no organismo.
A maioria das enzimas é muito específica, o que significa que cada uma delas é responsável por apenas um tipo de reação química na qual partículas específicas - substratos estão envolvidos, e somente elas podem interagir com uma determinada enzima.
A atividade dos catalisadores naturais depende de muitos fatores: o ambiente de reação, por exemplo, temperatura, pH, a presença de certos íons, ativadores - eles aumentam a ação de enzimas e inibidores que neutralizam essa atividade.
Enzimas: Estrutura
Como mencionado, a maioria das enzimas são proteínas, elas têm uma estrutura muito diversa: de várias dezenas de aminoácidos a vários milhares, dispostos em uma estrutura espacial diversa.
É a forma de sua formação (a chamada estrutura quaternária) e o fato de a maioria das enzimas serem muito maiores que os reagentes de suas reações é em grande parte responsável por sua atividade.
Isso se deve ao fato de que apenas uma determinada região na estrutura das enzimas é o chamado sítio ativo, ou seja, o fragmento responsável pela realização da reação.
A tarefa dos fragmentos restantes da molécula é anexar um substrato específico, menos frequentemente outros compostos que afetam a atividade da enzima.
É importante saber que a estrutura do catalisador é projetada de forma que o substrato de união seja idealmente combinado em termos de uma "chave para a fechadura".
Como todas as proteínas, as enzimas são produzidas nos ribossomos a partir do material genético que está fortemente compactado no núcleo - o DNA, criando assim a chamada estrutura primária.
Em seguida, sofre várias dobragens - mudando de forma, às vezes adicionando açúcares, íons metálicos ou resíduos de gordura.
O resultado de todos esses processos é a formação de uma estrutura quaternária ativa, ou seja, uma forma totalmente biologicamente ativa.
Em muitos casos, várias partículas de enzima se combinam para realizar uma série de reações químicas e, assim, acelerar o processo.
Acontece que em vários tecidos existem enzimas que catalisam a mesma reação, mas não são estruturalmente semelhantes entre si, chamamos de isoenzimas.
Os nomes das isoenzimas são os mesmos, apesar da diferença de localização e estrutura, mas essas diferenças têm aplicação prática. Assim, é possível determinar em testes de laboratório apenas as frações enzimáticas que vêm de um órgão específico.
Os mecanismos de ação das enzimas são diversos, mas do ponto de vista químico, sua tarefa é sempre reduzir a energia de ativação da reação. Essa é a quantidade de energia que os substratos devem ter para que o processo ocorra.
Este efeito pode ser alcançado criando um ambiente apropriado para realizar a reação, usando uma via química diferente para obter os mesmos produtos, ou disposição espacial apropriada dos substratos.
Cada um desses mecanismos pode ser usado por enzimas.
Regulação da atividade enzimática
A ação das enzimas depende de parâmetros ambientais: temperatura, pH e outros. Cada um dos catalisadores naturais tem seu próprio desempenho ideal sob certas condições, que podem ser amplamente diferentes dependendo de sua tolerância às condições ambientais.
No caso da temperatura, a maioria das reações enzimáticas ocorre mais rápido em temperaturas mais altas, mas em uma determinada temperatura, a eficiência da reação cai rapidamente, o que é causado por danos térmicos à enzima (desnaturação).
Em termos de estrutura, os hormônios podem ser divididos em dois grupos:
- simples - são apenas partículas de proteína
- complexo - que requer a ligação de um grupo não proteico - um cofator para sua atividade
Este último desempenha um papel fundamental na atividade adequada e na regulação das enzimas.
Já os cofatores podem ser divididos em dois grupos: os necessários para o funcionamento da enzima, fortemente associados a ela - são os chamados grupos protéticos, podem ser metais, moléculas orgânicas, como o heme.
O segundo grupo são as coenzimas, geralmente são responsáveis pela transferência de substratos ou elétrons, e sua ligação à enzima é fraca, este grupo inclui, por exemplo, ácido fólico, coenzima A. Vale a pena saber que muitas vitaminas desempenham o papel de cofatores.
Os inibidores realizam uma tarefa completamente diferente, são partículas que inibem a atividade enzimática ligando-se à enzima.
Existem vários tipos de inibidores:
- irreversíveis - causam a inativação permanente da molécula e a reação só pode ocorrer após a produção de uma nova enzima
- competitivo - neste caso, o inibidor tem uma estrutura semelhante ao substrato, por isso competem pelo sítio ativo. Se um inibidor estiver ligado, a reação falha, desde que o substrato esteja normal
- não competitivo - tais inibidores ligam a enzima em um lugar diferente do substrato que se liga, então ela pode se ligar à enzima, mas a reação não ocorre
Em uma concentração muito maior do substrato do que o inibidor, o efeito do inibidor competitivo é superado porque ele supera a "competição" pelo sítio ativo; no caso de não competitivo, seu efeito não pode ser superado aumentando a concentração do substrato.
Além da regulação dos sistemas ativador e inibidor, existem muitos outros métodos de controle da atividade enzimática.
Dizem respeito ao controle da produção celular ao nível da formação de proteínas, bem como à regulação do denominado processamento pós-tradução, ou seja, alterações na estrutura de uma molécula de proteína que ocorrem imediatamente após a sua síntese no ribossoma. Estas modificações são, por exemplo, encurtamento da cadeia polipeptídica.
Outros métodos de regulação dizem respeito à segregação e colocação de enzimas em áreas apropriadas: celular e em organelas específicas, ou no compartimento extracelular.
Existe outro mecanismo regulatório importante - feedback negativo - é o sistema de controle primário do sistema endócrino. Funciona com base no princípio da inibição.
Isso significa que, se uma enzima produz uma quantidade excessiva de um determinado hormônio, ela se liga a ela causando uma inibição da atividade e uma redução na síntese, de modo que o próprio produto da reação inibe sua produção.
Enzimas: Papel
Cada tecido do corpo humano produz um conjunto específico de enzimas, que define o papel dessas células no funcionamento do corpo. O que são essas enzimas é definido pelo código genético e quais regiões são ativas em uma determinada célula.
Milhares de reações químicas ocorrem no corpo humano a qualquer momento, cada uma das quais requer uma enzima específica, então seria difícil listar todas essas partículas presentes em nosso corpo.
No entanto, vale a pena conhecer alguns dos mais característicos:
- Enzimas digestivas - produzidas pelos tecidos do sistema digestivo, elas quebram os alimentos em compostos simples, porque somente estes podem ser absorvidos pelo sangue. Elas são enzimas extracelulares, portanto, cumprem sua tarefa principal fora das células nas quais são produzidas. Algumas dessas enzimas são formadas em uma forma inativa, chamadas de proenzimas ou zimogênios, e são ativadas no trato gastrointestinal. As enzimas digestivas incluem, por exemplo, amilase, lipase, tripsina.
- A miosina é uma enzima encontrada nos músculos, que quebra as moléculas de ATP que são portadoras de energia, graças ao qual faz com que as fibras musculares se contraiam.
- As peroxidases são enzimas oxidantes e catalases, ou seja, enzimas redutoras
- A acetilcolinesterase é uma enzima que decompõe a acetilcolina, um dos mensageiros do sistema nervoso
- A monoamina oxidase é a enzima mais abundante no fígado e é responsável pela quebra da adrenalina, norepinefrina e alguns medicamentos
- Citocoma oxidase, uma enzima intracelular muito importante responsável pelas mudanças de energia
- Lisozima, uma substância presente, por exemplo, em lágrimas ou saliva que cumpre funções protetoras, destrói patógenos
- Álcool desidrogenase, uma enzima do fígado responsável por quebrar o etanol
- Fosfatase alcalina, participa da construção óssea pelos osteoblastos
Enzimas: Nomenclatura
Os nomes das enzimas são frequentemente bastante complicados, uma vez que são derivados do nome da reação que realizam e do substrato envolvido na reação, por exemplo, 5-hidroxitriptofano descarboxilase.
Normalmente, o sufixo "-aza" é adicionado ao nome genérico de uma reação, e a segunda parte do nome da enzima forma o nome do composto que sofre essa reação.
Acontece que o nome é único, então vem de um substrato, por exemplo, lactase (enzima que decompõe a lactose).
Mais raramente, os nomes das enzimas derivam de um processo geral que ocorre com a sua participação, por exemplo, a girase de DNA, ou seja, a enzima responsável pela rotação das fitas de DNA.
Algumas enzimas acabam tendo nomes comuns ou nomes dados por seu descobridor, como pepsina (que decompõe as proteínas no trato digestivo) ou lisozima (uma enzima bactericida contida nas lágrimas).
Existe também um pequeno grupo de enzimas de restrição responsáveis pelo corte dos fios de DNA, neste caso o nome vem do microrganismo do qual a enzima foi isolada.
A União Internacional de Bioquímica e Biologia Molecular introduziu as regras para nomear enzimas e as dividiu em várias classes a fim de padronizar a nomenclatura.
Não substituiu os nomes descritos anteriormente, mas sim um suplemento usado principalmente por cientistas.
De acordo com as regras da União Europeia, cada enzima é descrita por uma sequência de caracteres: EC x.xx.xx.xx - onde o primeiro dígito representa a classe, as subclasses e subclasses subsequentes e, por fim, o número da enzima. As classes de enzimas mencionadas são:
• 1 - oxidorredutases: catalisa reações de oxidação e redução
• 2 - transferases: transfere grupos funcionais (por exemplo, fosfato)
• 3 - hidrolases: correspondem à hidrólise (decomposição) das ligações
• 4 - liases: quebra as ligações por um mecanismo diferente da hidrólise
• 5 - isomerases: são responsáveis pelas mudanças espaciais das moléculas
• 6 - ligases: conectar moléculas com ligações covalentes
Enzimas e medicamentos
A importância das enzimas para a saúde humana é enorme. Seu funcionamento adequado permite uma vida saudável e, graças ao desenvolvimento de dispositivos analíticos, aprendemos a diagnosticar várias doenças por meio da determinação de enzimas. Além do mais, somos capazes de tratar com sucesso as deficiências de algumas enzimas e as doenças resultantes, mas infelizmente ainda há muito o que fazer nesse sentido.
O tratamento das causas das doenças metabólicas ainda não é possível, porque não podemos modificar com segurança e eficácia o material genético para reparar genes danificados e, portanto, enzimas produzidas de maneira inadequada.
Doenças resultantes de enzimas disfuncionais
O bom funcionamento do nosso corpo depende muito do bom funcionamento das enzimas. Em muitos casos, os estados de doença afetam a quantidade de enzimas, fazendo com que sejam excessivamente liberadas das células ou, ao contrário, deficientes.A seguir, são apenas exemplos de doenças causadas por funções enzimáticas anormais, existem muitos mais deles.
- Bloqueios metabólicos ou doenças metabólicas
Os bloqueios metabólicos ou doenças metabólicas são um grupo de doenças hereditárias causadas pelo acúmulo de substâncias na célula devido à falta de uma enzima responsável por seu metabolismo. Existem tantos substratos acumulados ao longo do tempo que se tornam tóxicos para as células e para todo o organismo.
Existem vários milhares dessas doenças, seu número reflete a infinidade de enzimas encontradas no corpo humano, uma vez que as doenças metabólicas podem afetar a maioria dos genes que codificam as enzimas.
Os exemplos são galactosemia ou homocistinúria, que são doenças raras que mais frequentemente se manifestam imediatamente após o nascimento ou nos primeiros anos de vida.
- Tumores
Outro grupo de doenças em que o mau funcionamento enzimático pode estar envolvido é o câncer. Além de muitas outras funções, as enzimas também são responsáveis por regular a divisão celular, as chamadas tirosina quinases. Se essas enzimas falham nessa área, pode ocorrer divisão celular descontrolada e, portanto, um processo neoplásico.
- Enfisema
Uma doença menos comum é o enfisema, caso em que a elastase torna-se hiperativa. É uma enzima presente no tecido pulmonar responsável pela quebra da proteína elastina presente nos pulmões, entre outras.
Se estiver muito ativo, o equilíbrio entre a destruição e a construção é perturbado, causando cicatrizes e o enfisema se desenvolve.
Enzimas: uso diagnóstico
O diagnóstico médico moderno é baseado no uso de enzimas em suas determinações. Isso se deve ao fato de que os estados de doença levam direta ou indiretamente a um desequilíbrio de enzimas, causando aumento ou diminuição de sua quantidade no sangue.
Isto pode resultar não apenas de distúrbios de produção, mas também, por exemplo, da liberação de uma grande quantidade de enzima intracelular no sangue ou na urina como resultado de danos à sua membrana celular.
Exemplos de enzimas usadas em testes de laboratório são:
- Creatina quinase - uma enzima presente nos músculos, também no músculo cardíaco, seu aumento múltiplo pode indicar um ataque cardíaco, miocardite, doenças musculares - lesões, distrofia.
- Lactato desidrogenase - presente em todas as células do corpo, especialmente no cérebro, pulmões, glóbulos brancos e músculos. Seu grande aumento é observado em infarto do miocárdio, doenças musculares e hepáticas ou câncer.
- A fosfatase alcalina é encontrada principalmente no fígado e nos ossos, aqui é liberada pelos osteoblastos. Doenças desses órgãos podem causar seu crescimento, mas o excesso de fosfatase alcalina também pode indicar o processo de regeneração dos ossos - após cirurgia ou fratura.
- A fosfatase ácida ocorre em vários órgãos - fígado, rins, ossos, próstata, e do ponto de vista diagnóstico seu aumento pode indicar doenças ósseas e da próstata.
- Aspartato aminotransferase e alanina aminotransferase - são enzimas características do fígado, ocorrendo quase exclusivamente em hepatócitos, são usadas no diagnóstico de triagem básica de doenças hepáticas e seus aumentos de várias vezes em seus valores sempre levam a um diagnóstico adicional de doenças hepáticas.
- Glutamato desidrogenase e gamaglutamiltransferase - outras enzimas hepáticas, semelhantes às citadas anteriormente, são importantes no diagnóstico de doenças desse órgão e das vias biliares.
- A amilase é uma enzima presente em vários órgãos, mas a maior concentração é alcançada nas células do pâncreas e das glândulas salivares, seu diagnóstico é da maior importância em suas doenças.
- A lipase é outra enzima pancreática, que difere em especificidade da amilase, o que significa que a lipase ocorre apenas no pâncreas e desvios da norma na determinação dessa enzima indicam doença pancreática.
- A colinesterase é uma enzima que decompõe a acetilcolina - um transmissor no sistema nervoso, onde também está presente em maior quantidade, em diagnósticos é utilizada em envenenamentos por compostos organofosforados.
- Fatores de coagulação e fibrinólise - são substâncias produzidas pelo fígado envolvidas na coagulação do sangue, suas determinações são importantes não só na avaliação desse processo, mas também no monitoramento da função hepática.
- Alfa-fetoproteína - uma enzima hepática, cuja quantidade aumenta em doenças deste órgão, incluindo câncer.
- Proteína C reativa - produzida pelo fígado, participando da resposta imune, sua quantidade aumenta no sangue em condições inflamatórias - infecções, lesões, doenças autoimunes.
- Ceruloplasmina - outra enzima hepática, cujo aumento é característico da doença de Wilson.
- A piridinolina e a desoxipiridinolina são marcadores de reabsorção (destruição) óssea e caracterizam a função dos osteoclastos (células osteogênicas).
- Mioglobina - como mencionado anteriormente, é uma característica composta dos músculos, portanto, seu aumento indicará danos aos músculos esqueléticos ou cardíacos.
- Troponinas - os chamados marcadores de ataque cardíaco, são enzimas que regulam a contração das fibras musculares, especialmente abundantes no músculo cardíaco. Seus danos causam a liberação de grandes quantidades de troponinas no sangue, que é usado no diagnóstico de doenças cardíacas. No entanto, vale lembrar que um aumento das troponinas pode indicar não só um infarto, mas também sua insuficiência, defeitos valvares ou embolia pulmonar.
Todas as enzimas listadas acima podem ser classificadas em vários grupos:
- Enzimas secretoras - o limite inferior da norma é diagnóstico. Estas são enzimas que são fisiologicamente produzidas por órgãos, mas no caso de doenças seu número diminui, por exemplo, fatores de coagulação
- Enzimas indicadoras - o crescimento é importante. Este grupo de enzimas aparece em grandes quantidades devido a danos em órgãos e vazamento de enzimas, eles incluem, por exemplo, troponinas
- enzimas excretórias - são enzimas produzidas normalmente no lúmen de vários órgãos - boca, intestinos e trato urinário. Se sua saída for bloqueada, eles entram no sangue, por exemplo, amilase
Vale lembrar que as enzimas são utilizadas no próprio diagnóstico médico. As análises bioquímicas são realizadas com o uso de enzimas, e a interpretação adequada dos resultados das reações enzimáticas permite fornecer o resultado de um teste de laboratório.
Enzimas e tratamento
Muitos medicamentos atuam influenciando a ação de enzimas, seja fazendo com que atuem ou, ao contrário, sendo inibidores. Existem substitutos enzimáticos, como a pancreatina contendo lipase e amilase, usados na insuficiência pancreática.
Por outro lado, alguns grupos de drogas inibem a ação de enzimas, por exemplo, inibidores da enzima de conversão da angiotensina usados, entre outros, na hipertensão e na insuficiência cardíaca, ou alguns antibióticos, por exemplo, amoxicilina, que inibe a enzima transpeptidase bacteriana, que impede a construção da parede celular bacteriana e, portanto, inibe infecção.
Alguns venenos também atuam afetando enzimas. O cianeto é um potente inibidor da citocromo oxidase, um componente essencial da cadeia respiratória. O bloqueio impede a célula de obter energia, o que leva à sua morte.
Para o bom andamento dos processos vitais das células, é necessária a presença de muitas substâncias químicas, permanecendo em proporções estritas entre si, e entre as quais ocorrem constantemente reações químicas.
Essa tarefa é realizada por enzimas funcionando adequadamente, necessárias para que quase todas as reações químicas ocorram com a velocidade e a eficiência necessárias ao bom funcionamento do corpo humano.
A ação das enzimas acelera esses processos muitas vezes, muitas vezes até centenas de vezes, o que é importante, as próprias enzimas não se desgastam durante as reações que ocorrem.
A falta de catalisadores ou seu funcionamento inadequado pode resultar no surgimento de muitas doenças. Por outro lado, a modificação habilidosa de sua atividade permite que você trate com sucesso muitas doenças.
A Enzimologia (a ciência das enzimas) é extremamente extensa, e seu desenvolvimento pode trazer não apenas progresso científico, mas também contribuir ativamente para o desenvolvimento da medicina não só em termos de tratamento, mas também de diagnóstico.
Sobre o autor




---co-powoduje-niewiey-oddech-i-jak-sobie-z-nim-radzi.jpg)